Eine randomisierte, offene Phase-II-Studie zum Vergleich einer neoadjuvanten endokrinen Therapie in Kombination mit Trastuzumab, Pertuzumab +/- dem PI3K-Inhibitor Inavolisib bei Patienten mit HER2-positivem, HR-positivem, PIK3CA-mutiertem primären Brustkrebs - GeparPiPPa
Eine randomisierte, offene Phase-II-Studie zum Vergleich einer neoadjuvanten endokrinen Therapie in Kombination mit Trastuzumab, Pertuzumab +/- dem PI3K-Inhibitor Inavolisib bei Patienten mit HER2-positivem, HR-positivem, PIK3CA-mutiertem primären Brustkrebs - GeparPiPPa
EudraCT-No.: 2021-002323-38
EU-CT-Nummer: 2022-501152-28
Einführung
Die Studie untersucht die potenzielle Wirksamkeit und Sicherheit von Inavolisib bei der neoadjuvanten Behandlung von HER2-positivem, HR-positivem, PIK3CA-mutiertem Brustkrebs.
170 Patientinnen mit bestätigten Einschlusskriterien und PIK3CA-mutiertem Brustkrebs erhalten eine neoadjuvante endokrine Therapie in Kombination mit einer dualen Anti-HER2-Blockade, bestehend aus einer gebrauchsfertigen Fix-Dosis-Kombination von Pertuzumab und Trastuzumab als subkutane (PH-FDC SC) Formulierung q3w für 6 Zyklen (18 Wochen), randomisiert im Verhältnis 1:1 mit oder ohne Inavolisib.
Die endokrine Therapie besteht entweder aus Tamoxifen 20mg oder einem Aromatasehemmer +/- GnRH-Analogon für prämenopausale Frauen und Männer.
Zur Beurteilung der pCR-Rate unterziehen sich alle Patienten nach Abschluss der Studientherapie einer Operation oder Biopsie. Bei ypT0 und keinen Tumorresten in der Biopsie wird eine Operation empfohlen; bei Tumorresten in der Biopsie kann eine weitere neoadjuvante Behandlung erfolgen.
Aktuelles
Die Patientenrekrutierung hat begonnen. Die erste Patientin wurde im Januar 2023 registriert.
Gerne können Sie eine Überweisung an eines unserer Prüfzentren vornehmen. Eine Übersicht über alle teilnehmenden Zentren können sich unsere ärztlichen Interessenten auf der neuen Plattform Reesi ansehen.
Hier finden Sie den Link zum Login-Bereich
Seit November 2024 rekrutiert die Studie auch in Italien. Die erste Patientin aus Italien wurde am 17-Jan-2025 randomisiert.
Seit April 2025 rekrutiert die Studie auch in Spanien. Die erste Patientin aus Spanien wurde am 06-Mai-2025 randomisiert.
Seit Oktober 2025 rekrutiert die Studie auch in Rumänien. Die erste Patientin aus Rumänien wurde am 03-Feb-2026 randomisiert.

Design
Multizentrische, prospektive, randomisierte, offene, Phase-II-Studie im Parallelgruppendesign.
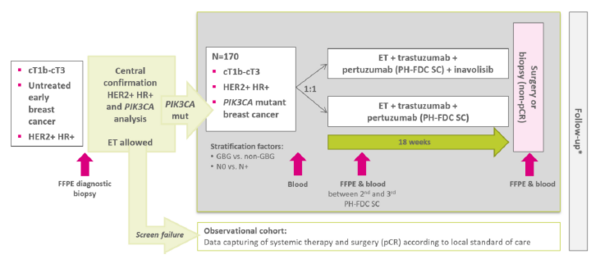
Die Ein- und Ausschlusskriterien, sowie detailliertere Informationen zum Studiendesign erhalten Sie im Kurzprotokoll auf der Unterlagen-Liste.
Kontakt
Jana Roßney