Eine randomisierte, offene Phase-II-Studie zum Vergleich einer neoadjuvanten endokrinen Therapie in Kombination mit Trastuzumab, Pertuzumab +/- dem PI3K-Inhibitor Inavolisib bei Patienten mit HER2-positivem, HR-positivem, PIK3CA-mutiertem primären Brustkrebs - GeparPiPPa
Eine randomisierte, offene Phase-II-Studie zum Vergleich einer neoadjuvanten endokrinen Therapie in Kombination mit Trastuzumab, Pertuzumab +/- dem PI3K-Inhibitor Inavolisib bei Patienten mit HER2-positivem, HR-positivem, PIK3CA-mutiertem primären Brustkrebs - GeparPiPPa
EudraCT-No.: 2021-002323-38
EU-CT-Nummer: 2022-501152-28
Einführung
Die Studie untersucht die potenzielle Wirksamkeit und Sicherheit von Inavolisib bei der neoadjuvanten Behandlung von HER2-positivem, HR-positivem, PIK3CA-mutiertem Brustkrebs.
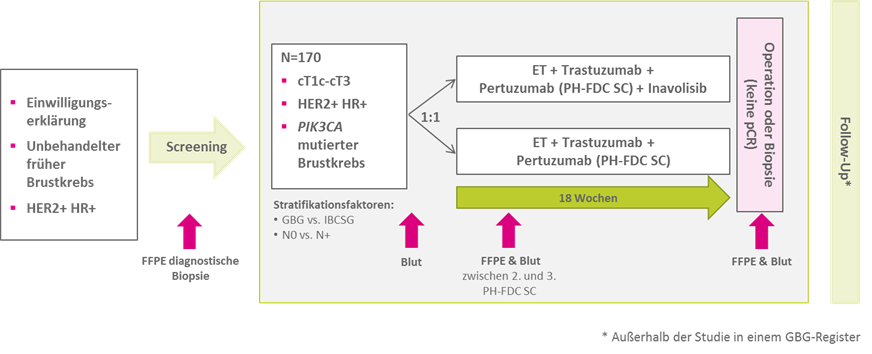
170 Patientinnen mit bestätigten Einschlusskriterien und PIK3CA-mutiertem Brustkrebs erhalten eine neoadjuvante endokrine Therapie in Kombination mit einer dualen Anti-HER2-Blockade, bestehend aus einer gebrauchsfertigen Fix-Dosis-Kombination von Pertuzumab und Trastuzumab als subkutane (PH-FDC SC) Formulierung q3w für 6 Zyklen (18 Wochen), randomisiert im Verhältnis 1:1 mit oder ohne Inavolisib.
Die endokrine Therapie besteht entweder aus Tamoxifen 20mg oder einem Aromatasehemmer +/- GnRH-Analogon für prämenopausale Frauen und Männer.
Zur Beurteilung der pCR-Rate unterziehen sich alle Patienten nach Abschluss der Studientherapie einer Operation oder Biopsie. Bei ypT0 und keinen Tumorresten in der Biopsie wird eine Operation empfohlen; bei Tumorresten in der Biopsie kann eine weitere neoadjuvante Behandlung erfolgen.
Aktuelles
Die Patientenrekrutierung hat begonnen. Die erste Patientin wurde im Januar 2023 registriert.
Design
Multizentrische, prospektive, randomisierte, offene, Phase-II-Studie im Parallelgruppendesign.
Die Ein- und Ausschlusskriterien, sowie detailliertere Informationen zum Studiendesign erhalten Sie im Kurzprotokoll auf der Unterlagen-Liste.
Kontakt
Konstantin Reissmüller